
El kit «todo en uno» Lucira es una prueba molecular (reacción de amplificación mediada por ciclo en tiempo real) de un sólo uso.
Silver Spring, Maryland, 18 de noviembre de 2020 /PRNewswire-HISPANIC PR WIRE/ — Hoy, la Administración de Alimentos y Medicamentos de los EE. UU. (FDA, por sus siglas en inglés) emitió una autorización de uso de emergencia (EUA) de la primera prueba de diagnóstico de COVID-19 para autodiagnosticarse en el hogar y que proporciona resultados rápidos.
El kit de prueba «todo en uno» Lucira COVID-19 es una prueba molecular (reacción de amplificación mediada por ciclo en tiempo real) de un sólo uso que está destinada a detectar el nuevo coronavirus SARS-CoV-2 que causa el COVID-19.
Nueva opción rápida
«La FDA continúa demostrando una velocidad sin precedentes en su respuesta a la pandemia. Si bien hay pruebas de diagnóstico de COVID-19 que han sido autorizadas para la recolección de muestras en el hogar, esta es la primera prueba que se puede hacer por completo y proporcionar resultados en el hogar.
Esta nueva opción de prueba es un avance de diagnóstico importante para abordar la pandemia y reducir la carga pública de la transmisión de enfermedades», dijo el comisionado de la FDA, el Dr. Stephen M. Hahn, M.D. «La acción de hoy subraya el compromiso continuo de la FDA de ampliar el acceso a pruebas de COVID-19».
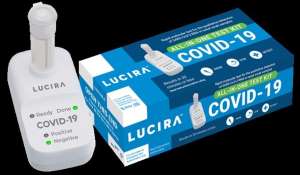
El kit de prueba «todo en uno» Lucira COVID-19 ha sido autorizada para uso en el hogar con una muestra que puede recolectar el usuario con hisopos nasales destinado para personas mayores de 14 años que su proveedor de atención médica sospeche tengan el COVID-19. También está autorizado para su uso en las instalaciones de los sitios de atención (por ejemplo, consultorios médicos, hospitales, clínicas de atención de urgencia y salas de emergencia) para todas las edades, pero un proveedor de atención médica debe recolectar las muestras cuando la prueba se usa en el sitio de atención para evaluar a personas menores de 14 años. Actualmente, la prueba está autorizada sólo para su uso con receta médica.
Cómo funciona
La prueba funciona haciendo girar el hisopo con la muestra recolectada por uno mismo dentro de un vial que luego se coloca en la unidad de prueba. En 30 minutos o menos, los resultados se pueden leer directamente desde la pantalla iluminada de la unidad de prueba que muestra si una persona es positiva o negativa al virus SARS-CoV-2. Los resultados positivos indican la presencia de SARS-CoV-2. Las personas con resultados positivos deben aislarse y buscar atención adicional de su proveedor de atención médica.
Las personas que resulten negativas a la prueba y experimenten síntomas similares a los del COVID-19, deben consultar con su proveedor de atención médica, ya que los resultados negativos no descartan que una persona tenga la infección de SARS-CoV-2.
«La autorización de hoy para una prueba completa en el hogar es un paso significativo en la respuesta nacional de la FDA al COVID-19. Una prueba que se puede administrar completamente fuera de un laboratorio o entorno de atención médica siempre ha sido una de las principales prioridades de la FDA para abordar la pandemia. Ahora, más estadounidenses que puedan tener el COVID-19 podrán tomar medidas de inmediato, basándose en sus resultados, para protegerse a sí mismos y a quienes los rodean», dijo el Dr. Jeff Shuren, M.D., J.D., director del Centro de Dispositivos y Salud Radiológica de la FDA.
«Esperamos trabajar de forma proactiva con los desarrolladores de pruebas para respaldar la disponibilidad de más opciones de pruebas en el hogar».
Seguimiento y monitoreo
Un componente importante para el éxito de las pruebas en el hogar es la capacidad de rastrear y monitorear los resultados de manera eficiente. Como se indica en esta autorización EUA, los proveedores de atención médica que prescriben deben reportar todos los resultados de las pruebas que reciben de las personas que utilizan la prueba a las autoridades de salud pública pertinentes de acuerdo con los requisitos locales, estatales y federales.
Lucira Health, el fabricante de la prueba también ha desarrollado etiquetas para las cajas, instrucciones de referencia rápida e instrucciones para el proveedor de atención médica para ayudar con los reportes.
Las pruebas de diagnóstico siguen siendo uno de los pilares a la respuesta de nuestra nación al COVID-19. La FDA continúa su compromiso con la salud pública y para buscar nuevos acciones que ayuden a que pruebas críticas estén disponibles para más estadounidenses a través de sus poderes de autorización de emergencia.







